Physiologische Wirkungen von Insulin
Stellen Sie sich auf eine Straßenecke und fragen Sie die Leute, ob sie wissen, was Insulin ist, und viele werden antworten: „Hat es nicht etwas mit Blutzucker zu tun?“ Das ist in der Tat richtig, aber eine solche Antwort ist ein bisschen so, als würde man sagen: „Mozart? War er nicht eine Art Musiker?“
Insulin spielt eine Schlüsselrolle bei der Kontrolle des Zwischenstoffwechsels, und das große Ganze ist, dass es die Verwendung von Kraftstoffen zur Speicherung oder Oxidation organisiert. Durch diese Aktivitäten hat Insulin tiefgreifende Auswirkungen auf den Kohlenhydrat- und Lipidstoffwechsel sowie auf den Protein- und Mineralstoffwechsel. Infolgedessen haben Störungen der Insulinsignalübertragung weitreichende und verheerende Auswirkungen auf viele Organe und Gewebe.
Der Insulinrezeptor und der Wirkmechanismus
Wie die Rezeptoren für andere Proteinhormone ist auch der Insulinrezeptor in die Plasmamembran eingebettet. Der Insulinrezeptor besteht aus zwei Alpha-Untereinheiten und zwei Beta-Untereinheiten, die durch Disulfidbrücken verbunden sind. Die Alpha-Ketten sind vollständig extrazellulär und beherbergen Insulin-Bindungsdomänen, während die verknüpften Beta-Ketten die Plasmamembran durchdringen.
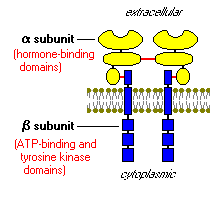
Der Insulinrezeptor ist eine Tyrosinkinase. Mit anderen Worten, es fungiert als Enzym, das Phosphatgruppen von ATP auf Tyrosinreste auf intrazellulären Zielproteinen überträgt. Die Bindung von Insulin an die Alpha-Untereinheiten bewirkt, dass sich die Beta-Untereinheiten selbst phosphorylieren (Autophosphorylierung), wodurch die katalytische Aktivität des Rezeptors aktiviert wird. Der aktivierte Rezeptor phosphoryliert dann eine Reihe von intrazellulären Proteinen, was wiederum ihre Aktivität ändert und dadurch eine biologische Antwort erzeugt.
Mehrere intrazelluläre Proteine wurden als Phosphorylierungssubstrate für den Insulinrezeptor identifiziert, von denen das am besten untersuchte das Insulinrezeptorsubstrat 1 oder IRS-1 ist. Wenn IRS-1 durch Phosphorylierung aktiviert wird, passieren viele Dinge. IRS-1 dient unter anderem als eine Art Docking-Center für die Rekrutierung und Aktivierung anderer Enzyme, die letztendlich die Wirkung von Insulin vermitteln. Ein detaillierterer Blick auf diese Prozesse wird im Abschnitt über die Insulinsignalübertragung gegeben.
Insulin- und Kohlenhydratstoffwechsel
Glucose wird durch Hydrolyse im Dünndarm aus Nahrungskohlenhydraten wie Stärke oder Saccharose freigesetzt und dann vom Blut absorbiert. Erhöhte Konzentrationen von Glucose im Blut stimulieren die Freisetzung von Insulin, und Insulin wirkt auf Zellen im gesamten Körper, um die Aufnahme, Verwendung und Speicherung von Glucose zu stimulieren. Die Auswirkungen von Insulin auf den Glukosestoffwechsel variieren je nach Zielgewebe. Zwei wichtige Effekte sind:
1. Insulin erleichtert den Eintritt von Glukose in Muskeln, Fettgewebe und verschiedene andere Gewebe. Der einzige Mechanismus, durch den Zellen Glukose aufnehmen können, ist die erleichterte Diffusion durch eine Familie von Hexosetransportern. In vielen Geweben – zum Beispiel in Muskeln – wird der Haupttransporter für die Aufnahme von Glukose (GLUT4) durch die Einwirkung von Insulin in die Plasmamembran freigesetzt.
Bei niedrigen Insulinkonzentrationen sind GLUT4-Glucosetransporter in zytoplasmatischen Vesikeln vorhanden, wo sie für den Transport von Glucose unbrauchbar sind. Die Bindung von Insulin an Rezeptoren auf solchen Zellen führt schnell zur Fusion dieser Vesikel mit der Plasmamembran und zur Insertion der Glucosetransporter, wodurch die Zelle in die Lage versetzt wird, Glucose effizient aufzunehmen. Wenn der Insulinspiegel im Blut abnimmt und die Insulinrezeptoren nicht mehr besetzt sind, werden die Glukosetransporter in das Zytoplasma zurückgeführt.
Es sollte hier angemerkt werden, dass es einige Gewebe gibt, die kein Insulin für eine effiziente Aufnahme von Glukose benötigen: Wichtige Beispiele sind Gehirn und Leber. Dies liegt daran, dass diese Zellen GLUT4 nicht zum Importieren von Glukose verwenden, sondern einen anderen Transporter, der nicht insulinabhängig ist.
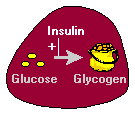
2. Insulin regt die Leber an, Glukose in Form von Glykogen zu speichern. Ein Großteil der aus dem Dünndarm aufgenommenen Glucose wird sofort von Hepatozyten aufgenommen, die sie in das Speicherpolymer Glykogen umwandeln.
Insulin hat in der Leber verschiedene Wirkungen, die die Glykogensynthese stimulieren. Zunächst aktiviert es das Enzym Hexokinase, das Glucose phosphoryliert und in der Zelle einfängt. Gleichzeitig hemmt Insulin die Aktivität der Glucose-6-Phosphatase. Insulin aktiviert auch einige der Enzyme, die direkt an der Glykogensynthese beteiligt sind, einschließlich Phosphofructokinase und Glykogensynthase. Der Nettoeffekt ist klar: Wenn die Versorgung mit Glukose reichlich ist, „sagt“ Insulin der Leber, dass sie so viel wie möglich davon für die spätere Verwendung einlagern soll.
3. Eine bekannte Wirkung von Insulin ist die Verringerung der Glukosekonzentration im Blut, was unter Berücksichtigung der oben beschriebenen Mechanismen sinnvoll sein sollte. Eine weitere wichtige Überlegung ist, dass mit sinkenden Blutzuckerkonzentrationen die Insulinsekretion aufhört. Wenn kein Insulin vorhanden ist, kann ein Großteil der Zellen im Körper keine Glukose mehr aufnehmen und alternative Kraftstoffe wie Fettsäuren zur Energiegewinnung einsetzen. Neuronen benötigen jedoch eine konstante Versorgung mit Glukose, die kurzfristig aus Glykogenreserven bereitgestellt wird.
Wenn der Insulinspiegel im Blut sinkt, nimmt die Glykogensynthese in der Leber ab und Enzyme, die für den Abbau des Glykogens verantwortlich sind, werden aktiv. Der Glykogenabbau wird nicht nur durch das Fehlen von Insulin, sondern auch durch das Vorhandensein von Glucagon stimuliert, das ausgeschieden wird, wenn der Blutzuckerspiegel unter den normalen Bereich fällt.
Insulin- und Fettstoffwechsel
Die Stoffwechselwege für die Verwertung von Fetten und Kohlenhydraten sind tief und eng miteinander verflochten. Angesichts der tiefgreifenden Auswirkungen von Insulin auf den Kohlenhydratstoffwechsel ist es naheliegend, dass Insulin auch wichtige Auswirkungen auf den Fettstoffwechsel hat, darunter:
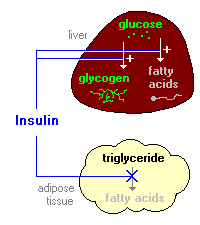
1. Insulin fördert die Synthese von Fettsäuren in der Leber. Wie oben diskutiert, stimuliert Insulin die Synthese von Glykogen in der Leber. Da sich Glykogen jedoch zu hohen Anteilen anreichert (ungefähr 5% der Lebermasse), wird die weitere Synthese stark unterdrückt.
Wenn die Leber mit Glykogen gesättigt ist, wird jede zusätzliche Glukose, die von Hepatozyten aufgenommen wird, in Wege geleitet, die zur Synthese von Fettsäuren führen, die als Lipoproteine aus der Leber exportiert werden. Die Lipoproteine werden im Kreislauf zerrissen und liefern freie Fettsäuren zur Verwendung in anderen Geweben, einschließlich Adipozyten, die sie zur Synthese von Triglycerid verwenden.
2. Insulin hemmt den Fettabbau im Fettgewebe, indem es die intrazelluläre Lipase hemmt, die Triglyceride unter Freisetzung von Fettsäuren hydrolysiert.
Insulin erleichtert den Eintritt von Glucose in Adipozyten, und innerhalb dieser Zellen kann Glucose zur Synthese von Glycerin verwendet werden. Dieses Glycerin wird zusammen mit den aus der Leber abgegebenen Fettsäuren zur Synthese von Triglycerid im Adipozyten verwendet. Durch diese Mechanismen ist Insulin an der weiteren Akkumulation von Triglycerid in Fettzellen beteiligt.
Insulin wirkt aus Sicht des ganzen Körpers fettschonend. Es treibt nicht nur die meisten Zellen dazu an, Kohlenhydrate anstelle von Fettsäuren zu oxidieren, um Energie zu gewinnen, Insulin stimuliert indirekt die Fettansammlung im Fettgewebe.
Andere bemerkenswerte Wirkungen von Insulin
Zusätzlich zu der Wirkung von Insulin auf den Eintritt von Glucose in die Zellen stimuliert es auch die Aufnahme von Aminosäuren und trägt wieder zu seiner anabolen Gesamtwirkung bei. Wenn der Insulinspiegel wie im nüchternen Zustand niedrig ist, wird das Gleichgewicht in Richtung intrazellulären Proteinabbaus verschoben.
Insulin erhöht auch die Durchlässigkeit vieler Zellen für Kalium-, Magnesium- und Phosphationen. Die Wirkung auf Kalium ist klinisch wichtig. Insulin aktiviert Natrium-Kalium-ATPasen in vielen Zellen, wodurch Kalium in die Zellen fließt. Unter bestimmten Umständen kann die Injektion von Insulin zum Tod von Patienten führen, da es die Kaliumkonzentrationen im Plasma akut unterdrücken kann.
Insulinmangel und überschüssige Krankheiten
Diabetes mellitus, die wohl wichtigste Stoffwechselerkrankung des Menschen, ist ein Insulinmangelzustand. Es ist auch eine signifikante Ursache für Krankheiten bei Hunden und Katzen. Zwei Hauptformen dieser Krankheit werden erkannt:
- Typ 1 oder insulinabhängiger Diabetes mellitus ist das Ergebnis eines offenen Insulinmangels. Der Beginn dieser Krankheit liegt typischerweise in der Kindheit. Es ist auf die Zerstörung von Beta-Zellen der Bauchspeicheldrüse zurückzuführen, höchstwahrscheinlich das Ergebnis einer Autoimmunität gegen eine oder mehrere Komponenten dieser Zellen. Viele der akuten Auswirkungen dieser Krankheit können durch eine Insulinersatztherapie kontrolliert werden. Die Beibehaltung einer strengen Kontrolle der Blutzuckerkonzentration durch Überwachung, Behandlung mit Insulin und Ernährungsmanagement wird die langfristigen nachteiligen Auswirkungen dieser Störung auf Blutgefäße, Nerven und andere Organsysteme minimieren und ein gesundes Leben ermöglichen.
- Typ 2 oder nicht insulinabhängiger Diabetes mellitus beginnt als Syndrom der Insulinresistenz. Das heißt, das Zielgewebe reagiert nicht angemessen auf Insulin. Typischerweise tritt diese Krankheit im Erwachsenenalter auf. Trotz monumentaler Forschungsanstrengungen war die genaue Natur der Defekte, die zu Typ-II-Diabetes führten, schwer festzustellen, und die Pathogenese dieses Zustands ist eindeutig multifaktoriell. Fettleibigkeit ist zweifellos ein Hauptrisikofaktor, aber in einigen Fällen von extremer Fettleibigkeit bei Menschen und Tieren ist die Insulinsensitivität normal. Da es zumindest anfänglich nicht möglich ist, ausreichende Mengen Insulin abzuscheiden, sind Insulininjektionen für die Therapie nicht geeignet. Vielmehr wird die Krankheit durch Ernährungstherapie und Hypoglykämika kontrolliert. Eine beträchtliche Anzahl von Patienten mit Typ-2-Diabetes benötigt jedoch Insulin.
Eine Hyperinsulinämie oder übermäßige Insulinsekretion ist am häufigsten eine Folge einer Insulinresistenz, die mit Typ-2-Diabetes oder dem metabolischen Syndrom assoziiert ist. Eine Hyperinsulinämie entsteht seltener durch einen insulinsekretierenden Tumor (Insulinom) in der Bauchspeicheldrüse. Eine Hyperinsulinämie aufgrund einer versehentlichen oder absichtlichen Injektion von übermäßigem Insulin ist gefährlich und kann lebensbedrohlich sein, da der Blutzuckerspiegel schnell sinkt und das Gehirn an Energie verliert (Insulinschock).
Original Webseite: http://www.vivo.colostate.edu/hbooks/pathphys/endocrine/pancreas/insulin_phys.html

Hinterlasse eine Antwort
Du musst angemeldet sein, um einen Kommentar abzugeben.